Reaksi Redoks dan Elektrokimia dalam Kehidupan Sehari-hari
Ini adalah bidang yang menghubungkan reaksi redoks dengan energi listrik.
Sel Galvanik (Sel Volta): Memanfaatkan Reaksi Redoks untuk Menghasilkan Listrik
Sel galvanik, juga dikenal sebagai sel volta, adalah perangkat yang menggunakan reaksi redoks spontan untuk menghasilkan energi listrik. Contoh klasik adalah Sel Daniel, yang terdiri dari elektroda seng dan tembaga yang terendam dalam larutan sulfat masing-masing dan dihubungkan oleh jembatan garam.
- Anoda: Elektroda tempat terjadinya oksidasi (dalam kasus ini, seng).
- Katoda: Elektroda tempat terjadinya reduksi (dalam kasus ini, tembaga).
- Jembatan Garam: Mempertahankan kenetralan listrik dengan memungkinkan ion mengalir di antara kedua sel.
Aliran elektron dari anoda ke katoda menghasilkan arus listrik yang dapat digunakan untuk memberi daya pada perangkat.
Sel Elektrolitik: Menggunakan Listrik untuk Mendorong Reaksi Non-Spontan
Tidak seperti sel galvanik, sel elektrolitik menggunakan energi listrik untuk mendorong reaksi redoks non-spontan. Proses ini dikenal sebagai elektrolisis. Contoh penting adalah elektrolisis air, di mana arus listrik dilewatkan melalui air untuk menguraikannya menjadi gas hidrogen dan oksigen.
Reaksi Redoks dalam Kehidupan Sehari-hari: Contoh-Contoh Praktis
Reaksi redoks bukan hanya konsep abstrak yang dipelajari di laboratorium; mereka adalah bagian integral dari banyak aspek kehidupan kita sehari-hari.
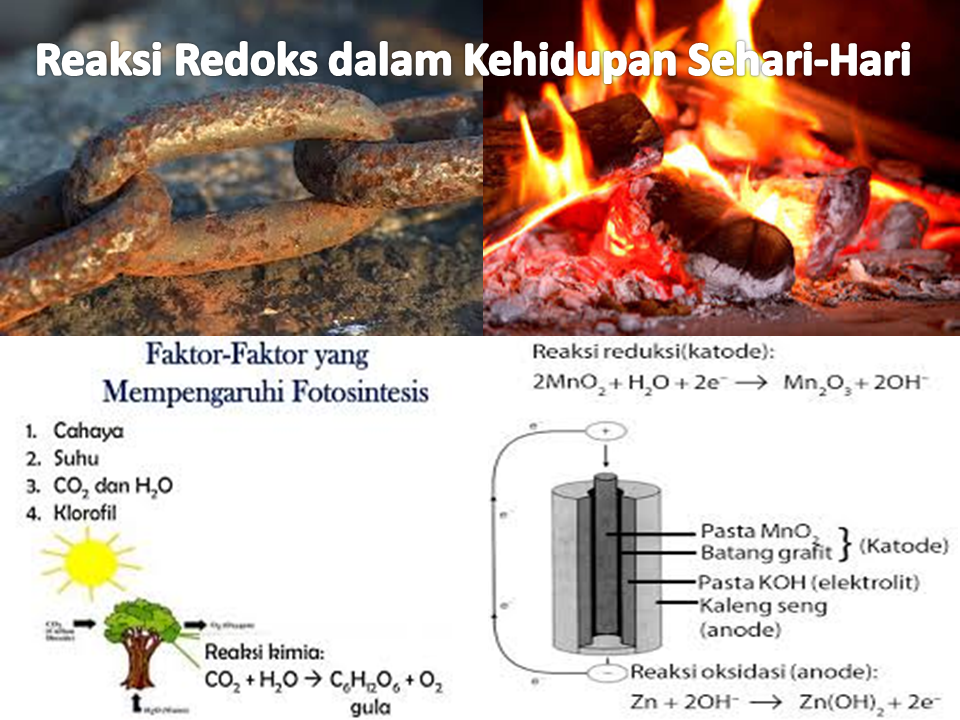
1. Korosi: Musuh Besi
Karat, pembentukan oksida besi pada permukaan besi atau baja, adalah contoh klasik reaksi redoks yang tidak diinginkan. Besi bereaksi dengan oksigen dan air di lingkungan untuk membentuk oksida besi (karat), yang melemahkan struktur logam.
- Pencegahan: Melapisi logam dengan cat, oli, atau pelapis pelindung lainnya untuk mencegahnya bersentuhan dengan oksigen dan air. Galvanisasi, yang melibatkan pelapisan besi dengan lapisan seng, adalah metode lain yang umum.
2. Pembakaran: Memberi Daya pada Dunia Kita
Pembakaran, seperti pembakaran kayu, propana, atau bahan bakar lainnya, adalah reaksi redoks cepat yang melepaskan energi dalam bentuk panas dan cahaya. Bahan bakar (yang mengandung karbon dan hidrogen) bereaksi dengan oksigen, menghasilkan karbon dioksida dan air.
3. Pernapasan: Bahan Bakar Kehidupan
Di dalam tubuh kita, pernapasan seluler adalah serangkaian reaksi redoks yang kompleks yang memecah glukosa (gula) untuk menghasilkan energi. Oksigen berperan sebagai agen oksidasi akhir, menerima elektron dan membentuk air. Energi yang dilepaskan digunakan untuk memberi daya pada berbagai proses seluler.
4. Fotosintesis: Keajaiban Alam
Fotosintesis, yang dilakukan oleh tumbuhan, alga, dan bakteri tertentu, adalah kebalikan dari pernapasan seluler. Menggunakan energi cahaya untuk mengubah karbon dioksida dan air menjadi glukosa dan oksigen. Air dioksidasi, melepaskan elektron dan oksigen, sementara karbon dioksida direduksi menjadi glukosa.
5. Pemutihan: Menghilangkan Noda dan Disinfeksi
Pemutih, seperti natrium hipoklorit (NaClO), bekerja dengan reaksi redoks untuk menghilangkan noda dan membunuh mikroorganisme. Hipoklorit mengoksidasi molekul berwarna dalam noda, membuatnya tidak berwarna. Ia juga mengoksidasi molekul penting dalam bakteri dan virus, melumpuhkannya.
6. Baterai: Sumber Daya Portabel
Baterai, yang memberi daya pada ponsel, laptop, dan berbagai perangkat portabel kita, mengandalkan reaksi redoks untuk menghasilkan listrik. Berbagai jenis baterai menggunakan reaksi kimia yang berbeda, tetapi prinsip dasarnya tetap sama: reaksi redoks spontan menghasilkan aliran elektron yang dapat digunakan untuk melakukan pekerjaan.
7. Elektroplating: Lapisan Pelindung dan Dekoratif
Elektroplating menggunakan elektrolisis untuk melapisi lapisan tipis logam ke permukaan benda lain. Proses ini digunakan untuk meningkatkan penampilan, daya tahan, atau ketahanan terhadap korosi. Misalnya, perhiasan perak sering kali dilapisi dengan lapisan tipis emas untuk meningkatkan penampilannya.





